R:-Hまたは-CH2COOH
陶芸材料の物理化学的性質
陶芸材料のindexです。物理化学的性質という視点で書いていますので、釉薬調合などの実用上はあまり参考にならないかも知れません。毒劇物取締法における毒物及び劇物には毒及び劇の記載を、消防法における危険物には危の記載をしました。取り扱い時は吸入したり火に近づけないように(窯焚きの時は別)注意して下さい。その他の材料も絶対安全というわけではなく、「安全性のデータがない」というのも数多くあります。基本的に陶芸材料は化学薬品ですので注意深く取り扱って下さいね。
1.毒物、劇物及び危険物の定義
毒物・・・経口致死量30mg/kg以下の物質(mg/kgは体重1kg当たりの摂取量を示します)
劇物・・・経口致死量30~300mg/kgの物質
危険物・・・加熱、混合などにより発火する可能性のある物質
※磁性について
磁性は物質中に含まれる不対電子の電子スピンに由来するもので、学術的には重要な性質のため一部記載しています。ただ、一般の陶磁器には(磁という字を使っているにもかかわらず)あまり関係のない性質ですので無視してもらっても構いません。
常磁性:磁気モーメントの向きが揃っているため磁場の中に置くとその向きと同じ磁化を生じる(磁石にくっつく)性質。ただし、自発磁化は生じない。
強磁性:磁気モーメントの向きが揃っており、自発磁化を生じる(それ自身が磁石となり得る)性質。
反磁性:不対電子が存在せず、磁気モーメントがないため、磁場の中に置くと磁力線をはじき出す(磁石にくっつかない)性質。
反強磁性:不対電子が存在し、磁気モーメントの向きは揃っているが、物質の中で磁気モーメントの向きが逆向きとなっている部分があり、トータルとして磁化を生じない性質。
フェリ磁性:磁気モーメントが揃っており、物質の中で磁気モーメントが逆向きの部分があるが、トータルすると磁化を生じる性質。
あ
亜鉛華[zinc oxide]:
化学組成ZnO。無色の六方晶系結晶。密度5.67g/cm3。融点は1980℃。約300℃で黄色を呈するが冷却すると元に戻る。水に不溶だが酸、アルカリに可溶。
アルミナ[alumina]:
酸化アルミニウムのこと。化学組成Al2O3。9種の変態が報告されているが、代表的なのはα-アルミナ及びγ-アルミナである。窯業で用いるのはα形。三方晶系コランダム型構造。融点2050℃の無色の固体。酸、アルカリにほとんど溶けないが融解アルカリとは反応する。γ形は格子欠陥を持つスピネル型構造を有し、加熱すると1000℃付近でα形に転移する。
アルメル:[alumel]
ニッケル、アルミニウム、ケイ素及びマンガンなどの合金。熱電対に用いられる。K型熱電対(-脚)の組成はNi94%、Al3%、Si1%、Mn2%。
ウイレマイト[willemite]
別名珪亜鉛鉱。化学組成2ZnO・SiO2。六方晶系の結晶でオランダ国王Willem1世の名にちなんで命名された。亜鉛結晶釉で析出する。
塩化カリウム[potassium
chloride]:
化学組成KCl。無色の立方晶系結晶。密度1.98g/cm3。融点770℃、沸点1510℃。水に可溶で溶解度は35.9g/100g水(25℃)。エタノールに難溶(1g/250cm3、室温)、アセトンに不溶。
塩化銀[silver chloride]:
化学組成AgCl。立方晶系の無色固体(岩塩型構造)。密度5.56g/cm3。水に難溶。高温で光伝導性を持ち、有機化合物または水の存在下で黒化する。
塩化コバルト[cobalt
chloride]:
酸化数2及び3の化合物がある。陶芸材料として用いられるのは3。化学組成CoCl2。無水塩は青色の三方晶系結晶。密度3.37g/cm3。融点735℃。吸湿して水和物となるが最も安定なのは六水和物(CoCl2・6H2O)。六水和物は密度1.92、融点86℃の赤色の単斜晶系結晶。
塩化バリウム[barium
chloride]:劇
化学組成BaCl2。低温では斜方晶系結晶、密度3.92g/cm3。923℃で立方晶系に転移する。水溶液から常温で得られる二水和物は無色で扁平な単斜晶系結晶(陶芸材料としてはこちらが一般的)。加熱すると125℃で水分を脱離する。
塩化ナトリウム[sodium
chloride]:
化学組成NaCl。無色の立方晶系結晶。密度2.17g/cm3。融点801℃、沸点1413℃。溶解度は35.7g(0℃)、35.9g(25℃)、39.3g(100℃)/100g水。エタノールに難溶。グリセリンには可溶(1g/10cm3グリセリン、25℃)0~-21.3℃では二水和物を与える。
か
カーボランダム[carborundum]:
炭化ケイ素の項参照。元来は米国Carborundum社の商品名だが、炭化ケイ素の一般名として用いられている。carborundumの名前はダイヤモンド(carbon)と酸化アルミニウム(corundum)の中間的な硬度を示す性質に由来している。
カオリン[kaolinite]:
代表的な粘土鉱物で理想化学組成はAl2O3・2SiO2・2H2O。透明から半透明を呈する薄片状結晶でモース硬度2~2.5.密度2.6~2.63g/cm3。水と反応して水和物を作り、粘性を帯びる。加熱すると600℃で完全脱水し、950℃で発熱してムライトを生成する。
クロメル:[chromel]
金属クロム、ニッケル及び鉄の合金。熱電対に用いられる。K型熱電対(+脚)の組成はNi90%、Cr10%。
クロメル-アルメル熱電対:[chromel-alumel
thermocouple]
卑金属系統の代表的な熱電対で米国Hoskin社の商品名。JIS規格ではK型熱電対と呼んでいる(熱電対の項参照)。+脚にクロメル線、-脚にアルメル線を使用している。常用使用温度は線径により異なるが、850~1000℃くらい。基準接点を0℃とした場合、1000℃での熱起電力は約41mV、感度は39μV/℃。
珪酸ジルコニウム[zirconium
silicate]
化学組成ZrO2・SiO2。無色透明結晶。密度4.0~4.7g/cm3。加熱すると1800℃で分解し、二酸化ケイ素の白煙を上げて残りは2000℃以上で熔ける。水に不用。酸には侵されないが、水酸化アルカリと融解すると分解する。
珪酸鉄:[iron silicate]
酸化数2及び3について3種類の化合物がある。
・オルト珪酸鉄(Ⅱ)
化学組成2FeO・SiO2。淡黄色の透明な斜方晶系結晶。密度3.90~4.24g/cm3。融点約1500℃。空気中に放置すると表面が酸化されて着色する。
・メタ珪酸鉄(Ⅱ)
化学組成FeO・SiO2。茶色のアスベスト状結晶。単斜晶系。密度3.5
g/cm3。融点1550℃。
・メタ珪酸鉄(Ⅲ)
化学組成は一定しない。クロルオパールまたはノントロン石の主成分として天然に存在する。密度1.727~2.105
g/cm3。
珪酸ナトリウム[sodium
silicate]:
各種組成の化合物があるが、実用上用いられるのは水溶性の塩である。詳しく同定されているのはメタケイ酸ナトリウムNa2SiO3(斜方晶系)とオルトケイ酸ナトリウムNa4SiO4(六方晶系)である。どちらも水に易溶で水溶液はアルカリ性を示し、酸を加えるとゲル状珪酸が得られる。これらの混合物の水溶液は水ガラスと呼ばれる。
珪石[Silica]:
主成分はα-石英(α-quartz:SiO2)。まれにβ-石英やクリストバライトも混入する。573℃でβ-石英に、870℃でトリディマイトに、さらに1470℃でβ-クリストバライトに転移する。結晶は複六方錘形でモース硬度7。密度2.65g/cm3。ガラス光沢の無色結晶であるが、不純物により様々に呈色する。圧電性や旋光性が顕著。
骨灰:
主成分はリン酸三カルシウムCa3(PO4)2。α(単斜晶系)、β(三方晶系)、α(-)の3種の変態を持つ。室温で安定なのはβ形。加熱すると1120℃でα形に、1470℃でα(-)形に転移する。水には溶けないが、クエン酸溶液に溶ける。燐灰石の主成分。
さ
酸化コバルト[cobalt
oxide]:
単にコバルトと呼ばれることが多い。酸化数2、3の化合物が報告されているが、安定に存在するのはCoO及びCo3O4である。陶磁器の着色剤として用いられるのはCoO。青緑色の立方晶系結晶。岩塩型構造。密度は6.45g/cm3。酸及びアルカリに溶解。常温では常磁性を示すが、7℃以下で反強磁性転移を起こし、結晶構造が歪んで正方晶系となる。
酸化錫[tin oxide]:
酸化数2及び4の化合物があるが、陶芸で用いるのは酸化錫(Ⅱ)(SnO)。黒色の正方晶系結晶。立方晶系の変態もある。密度は6.45g/cm3。酸やアルカリに溶け、それぞれSn2+塩及び亜スズ酸塩を生ずるが水には不溶。水素中で熱すれば錫に、空気中で熱すれば酸化錫(Ⅳ)(SnO2)になる。
酸化チタン[titanium oxide]
数種の酸化物があるが、陶芸材料として用いるのは酸化チタン(Ⅳ)(TiO2)。ルチル、アナタース、ブルッカイトの3種の変態を持つ。ルチル、アナタースは正方晶系、ブルッカイトは斜方晶系。融点1840℃(ルチル)。
酸化鉄[iron oxide]:
酸化数2及び3の以下の化合物がある。
・酸化第一鉄:
化学組成はFeO。黒色の立方晶系(岩塩型構造)結晶。室温で放置しておくと徐々に酸化される傾向があるが、その速度は遅い。鉄欠損型不定比化合物で最大約4%まで組成変化があり、これに伴って格子定数も変化する。-75℃以下で反強磁性体に転移する。導電性。
・酸化第二鉄:
化学組成Fe2O3。別名三二酸化鉄。酸化第二鉄にはα形(ヘマタイト)及びγ形(マグヘマイト)がある。弁柄と呼ばれるα形は赤茶色の三方晶系結晶(コランダム型構造)。密度5.24g/cm3。融点は1570℃とされているが、高温では分解するため正確には測定できない。ごく弱い強磁性体と考えられる。室温では絶縁体。
・酸化鉄(Ⅱ)鉄(Ⅲ):
化学組成Fe3O4.別名四三酸化鉄。黒色の立方晶系結晶で欠陥を持つ逆スピネル型構造。融点は1600℃であるが、空気中で熱するとFe2O3となる。585℃でフェリ磁性体に転移する。常温では半導体であるが、高温では金属伝導性を示す。
酸化銅[copper oxide]:
酸化数が1(Cu2O、酸化第一銅)及び2(CuO:酸化第二銅)の2種類がある。釉薬の発色剤として使用するのは主に酸化第二銅。黒色の単斜晶系結晶。1100℃以上でCu2OとO2とに分解する。酸、アンモニア水に可溶。
酸化鉛[lead oxid]:
酸化数1、2、4の化合物がある。陶芸材料として使うのは2及び2と4の混合原子価化合物。
・酸化鉛(Ⅱ)劇
化学組成PbO。密陀僧、あるいは金密陀といわれる。α、βの2種類の変態がある。密陀僧はα形。赤色の正方晶系結晶。低温で安定。金密陀はβ形。黄色の斜方晶系結晶。両性酸化物で酸、アルカリに可溶。劇物。
・酸化鉛(Ⅱ)鉛(Ⅳ)
化学組成Pb3O4。鉛丹、光明丹ともいう。赤色の正方晶系結晶。密度9.1g/cm3。500℃以上ではPbOとなる。水に不溶。
酸化マグネシウム[magnesium
oxide]
陶芸ではマグネシア、苦土の方が通りが良いかも。化学組成MgOの無色立方晶系結晶。密度3.58g/cm3。水にわずかに溶けて発熱し、水酸化マグネシウム(Mg(OH)2)となる。酸、アンモニウム塩溶液に可溶。
酸化マンガン[manganese
oxide]:
陶芸で用いるものは酸化マンガン(Ⅳ)(MnO2)。単にマンガンと呼ぶことが多い。暗緑色の立方晶系結晶。密度5.18cm3。融点1840℃。半導体で常磁性体。‐153℃以下で結晶構造が歪んで三方晶系となり、反強磁性体に転移する。酸に溶けてMn2+を生じる。
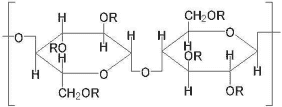
CMC[carboxymethylcellulose]:
別名カルメロース。セルロースのOH基にカルボキシメチル基CH2COOHをエーテル結合させたもの。カルボキシル基のpKa(酸解離指数)は3.5~4.2。蛋白質の分画に用いられるほか、医薬品の添加物(結合剤)としても用いられる。水を吸って著しく膨潤し、粘性を帯びる。易溶性のナトリウム塩も「セロゲン」の商品名で同様の用途で用いられている。

R:-Hまたは-CH2COOH
硝酸鉛[lead nitrate]:劇・危
化学組成Pb(NO3)2。無色の立方晶系または単斜晶系結晶。密度は4.53g/cm3(20℃)。470℃で分解する。溶解度は56.5g/100g(水)。アンモニア、ヒドラジンに易溶。
石灰石[limestone]:
主成分は炭酸カルシウム(CaCO3)。六方晶系及び斜方晶系のものがある。加熱により以下のように分解する。
CaCO3→CaO+CO2
水に溶けにくい。溶解度は1.34g(0℃)、0.82g(25℃)、0.20g(100℃)/水1L。酸に溶けてCO2を発生する。
た
タルク[talc]:
別名滑石。理想化学組成は3MgO・4SiO2・H2O。三斜晶系。葉片状あるいは鱗状の結晶。もっとも柔らかい鉱物(モース硬度1)のひとつで、密度2.82g/cm3。熱及び伝導度が低い。
炭化ケイ素[silicon carbide]:
化学組成SiC。密度3.2g/cm-3、融点2700℃以上。一般名「カーボランダム」は米国Carborundum社の商品名。六方晶系のα形と立方晶系のβ形、および非晶質繊維状のものがある。α形にはc軸の長周期的構造に由来する多数の多型(ポリタイプ)が存在する。硬度はダイヤモンドについで大きい。禁止帯のエネルギーギャップが3eV程度のため、半導体材料に用いられる他、研磨剤、耐熱材料に使われる。
炭酸ストロンチウム[strontium
carbonate]:
化学組成SrCO3。室温では無色の斜方晶系結晶。融点(CO2気流中)は1497℃。密度3.62g/cm3。空気中で熱するとSrOとCO2に分解する。溶解度は0.90mg/100g水(25℃)。酸に溶けてCO2を発生する。
炭酸銅[copper carbonate]:劇
酸化数1のCu2CO3(黄色の固体)もあるが、陶芸用材料で炭酸銅といえば塩基性炭酸銅と呼ばれる複塩のCuCO3・Cu(OH)2を指す。CuCO3単独の組成を持つものは報告されていない。その他炭酸ナトリウムや炭酸カリウムとの複塩も知られている。
炭酸鉛[lead carbonate]:
広義ではPbCO3(無色の斜方晶系結晶)のことであるが、陶芸では複塩の塩基性炭酸鉛2PbCO3・Pb(OH)2(鉛白)を指す。
炭酸バリウム[barium
carbonate]:劇
化学組成BaCO3。3種の変態を持つが、安定なものは斜方晶系。密度4.43g/cm3。水に難溶。CO2中で811℃で六方晶系に転移し、982℃で立方晶となる。毒重石の別称からもわかるように有害な物質であるので取扱は慎重に。
炭酸マグネシウム[magnesium
carbonate]:
別名菱苦土鉱(マグネサイト)。無色の三方晶系結晶。密度3.04g/cm3。600℃でMgOとCO2に分解する。水に難溶。酸に溶ける。無水物の他に1、3、5水和物が存在する。
炭酸リチウム[lithimu carbobate]:
化学組成Li2CO3。無色の単斜晶系結晶。密度2.10g/cm3。融点は726℃。1500℃以上でLi2OとCO2に分解する。溶解度は1.54g(0℃)、0.72g(100℃)/100g水。エタノールに不溶。
長石[feldspar]:
化学組成はM2O・Al2O3・2SiO2(M=K,
Naなど)。造岩鉱物のうち、最も優勢なアルミノ珪酸塩。長石の微細組織と構造はSi-Al分布の秩序・無秩序現象を反映して著しく複雑である。通常、曹長石(Na2O・Al2O3・2SiO2)、カリ長石(K2O・Al2O3・2SiO2)、灰長石(CaO・Al2O3・2SiO2)などを端成分とする固溶体である。結晶は白色~淡黄色の短冊状を呈し、モース硬度6~6.5、密度2.5~2.9g/cm3である。灰長石(anorthite)はマット釉の艶消し調の原因となる。
灯油[kerosene]:危
原油を蒸留し、沸点150~280℃で留出する留分。無色~やや黄色を帯び、蛍光を発する。比重0.790~0.830。引火点254℃。
ドロマイト[dolomite]:
苦灰石、白雲母とも呼ぶ。理想化学組成CaMg(CO3)2。三方晶系の無色~白色、灰色の結晶。モース硬度3.5~4.0。密度2.85~3.02g/cm3。
は
白金-ロジウム-白金熱電対:[platinum-rhodium-platinum
thermocouple]
工業用に使われている代表的な貴金属系熱電対。JIS規格ではロジウムの含有量によりB型、R型、S型に分けられている(熱電対の項参照)。Seebeck係数の温度依存性が少ないために精密測定に向いており、陶芸で用いるパイロメーターの多くがこれを使用している。常用使用温度は線径0.5mmのもので、B型が1500℃、R,S型が1400℃。
弁柄:
酸化鉄の項を参照。
硼砂[borax]:
理想化学組成Na2B4O7・10H2O(硼酸ナトリウム)。単斜晶系。モース硬度2~2.5。密度1.715g/cm3。無色から半透明の柱状結晶。溶解度は4.7g/100g水(20℃)。水溶液は強アルカリ性。無水塩は878℃で融解してガラス状となる。
ま
マグネサイト:
炭酸マグネシウムの項を参照。
や
葉蝋石[pyrophyllite]:
化学名パイロフィライト。理想化学組成Al2O3・4SiO2・H2O。単斜晶系、葉片または繊維状の白色結晶。モース硬度1~1.5.密度2.84g/cm3。750~800℃で熱分解して1200℃以上でムライトとクリストバライトに再結晶する。