陶芸を語る上でまず忘れてはならないもの、それは粘土の存在です。陶芸材料店に行くといろんな粘土が売っています。信楽、備前、五斗蒔(ごとまき)・・・。さらに白土とか赤土とかありますよね。それぞれによって手触りや成形性も違うし、焼きあがったときの色合いも違う。違いが分かってもどうしてこんな違いがでるのかよくわからない。その原因を知るには粘土を原子レベルまで分解しなければなりません。原子レベルで粘土を見たとき一体どのような顔をしているのでしょうか。
1‐1‐1.粘土鉱物の基本構造
粘土は粘土鉱物と呼ばれる非常に細かな粒子が集まってできたものです。粘土鉱物の大部分は結晶質(crystalline
state)と呼ばれ、原子が周期的に配列したものです。例えば、食塩の結晶はナトリウム原子と塩素原子が上下左右方向に交互に規則正しく配列したものです。
これに対して原子が周期的に配列していない物質、特に固体を非晶質(amorphas
state)と呼びます。窓にはまっているガラスはその代表的なものでケイ素原子と酸素原子、さらにナトリウムやカリウム原子が不規則にならんでいるものです。
それでは粘土鉱物は何からできているのでしょうか?粘土は主にケイ素原子(Si)、酸素原子(O)、アルミニウム原子(Al)及び水素原子(H)などからなっています。結晶質の粘土鉱物の結晶構造を見るといくつかの共通の基本構造が見られます。

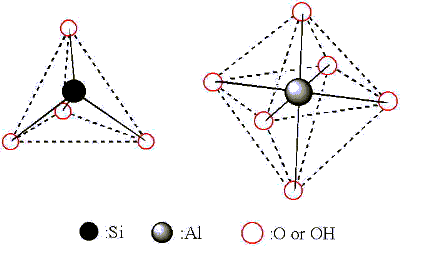
図1. 粘土鉱物の基本構造、ケイ素四面体及び水酸化アルミニウム六面体
図1に示すように粘土の基本構造はケイ素を中心として酸素が四面体になるように並んだケイ酸四面体と、アルミニウムを中心として酸素と水素原子(水酸基と呼びます)あるいは酸素原子単独が六面体を形成する水酸化アルミニウム六面体の二つがあります。これらの基本構造は粘土の粒子の中でてんでばらばらに存在するわけではなく、ケイ素四面体はケイ素四面体同士で、水酸化アルミニウムそれ同士で行儀よくならんでいますその並び方は図2に示すようにケイ酸四面体が層となって面状に広がり、その下層に水酸化アルミニウム八面体が第2層として広がっています。つまり粘土はケイ酸四面体と水酸化アルミニウム六面体の複合体ということができます。
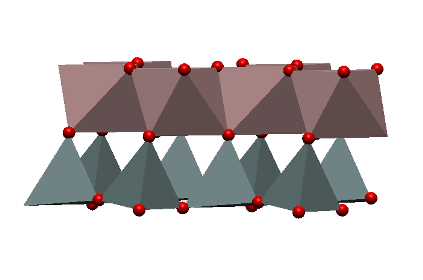
図2. ケイ酸四面体と水酸化アルミニウム六面体の複合様式。灰色がケイ酸、赤が水酸化アルミニウム。赤い点は酸素原子
これらの多面体では各頂点の位置に酸素、あるいは水酸基などの陰イオンが、それらの陰イオンに囲まれた位置にケイ素やアルミニウムなどの陽イオンが存在します。これらの複合体がちょうど紙を何枚も重ねたように層状に広がり(フィロシリケートと呼びます)、巨視的に見たときに粘土粒子を形作っているのです。
かちかちになって固まった粘土を金槌で砕くと、粘土は粉々になるのではなく、皮をむくようにはがれていくことがよくあります。これは粘土の層状構造を反映していて、層がはがれるように壊れていくためです。
さて、ケイ素四面体層と水酸化アルミニウム八面体層との複合体には図3に示すように2つのタイプがあります。1つは四面体層と六面体層が1つずつ組み合わさって出来た1:1型、もう一つは四面体層2つと六面体層1つからなる2:1型です。わかりやすく言うとオープンサンドイッチと普通のサンドイッチというところでしょうか?
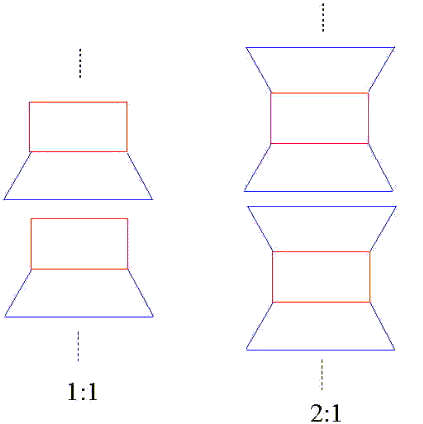
図3. ケイ酸四面体層と水酸化アルミニウム六面体層の複合層構造の模式図。青がケイ酸、赤が水酸化アルミニウム
さて、それぞれの層ですが、ケイ酸四面体層と水酸化アルミニウム六面体層は化学結合によって硬く結びついているのですが、それぞれの複合層の間にもやはり相互作用が存在します。それは化学結合ほど強固なものではありませんが、水素結合や分子間力と呼ばれる力で結びついています。ケイ酸四面体層と水酸化アルミニウム六面体層が強力接着剤でくっついているとしたら、それぞれの複合体層同士はすぐはがれるのりでくっついているといった感じです
1‐1‐2.粘土の分化
1つの層構造で電荷が中性であるとき、すなわち陽イオンの数と陰イオンの数が等しい時は層と層の間は何も存在しないか、水分子があるだけで、層間は先に述べた水素結合や分子間力により、つなぎとめられています。しかし、自然界では八面体層や四面体層のケイ素やアルミニウムといった陽イオンがイオン半径が近く、電荷の数が少ない陽イオン(マグネシウムやアルミニウム)に置換されることも多々あります。そうすると、層構造の電荷は全体として、マイナスとなってしまいます。このような粘土鉱物ではその電荷を中和するため層間に他の陽イオンや他の八面体層が入って層同士を結びつけるのりの役目をするとともに結晶構造全体の電荷を中性としています(八面体層が入る場合を2:1:1型の複合層と呼ぶこともあります)。これらの陽イオンは次に述べる粘土の成形性に大きな役割を果たしていると考えられます。以上のように粘土鉱物は
①四面体層と八面体層の構成比率
②八面体層中の陽イオンの下数、種類、置換割合
③四面体層中の陽イオンの種類、置換割合
④層間中の陽イオンの種類、存在割合
⑤層間中の水の存在割合
等の化学構造的な違いに対して表1に示すような様々に分類されています。その他にも異なる粘土鉱物の層構造が混じりあっているような複雑なものも知られています。
表1.主な粘土鉱物の種類と分類(それぞれの原子の係数の組で一つの構成単位を表す)
| 層構造型 | 八面体層の中心原子 | 四面体層の中心原子 | 八面体の頂点に位置する陰イオン | 層間に存在する陽イオンなど | 粘土鉱物の種類 |
| 1:1 | 2Al | 2Si | 5O及び4OH | - | カオリナイト |
| 1:1 | 2Al | 2Si | 5O及び4OH | H2O | ハロイサイト |
| 1:1 | 3Mg | 2Si | 5O及び4OH | - | クリソタイル |
| 2:1 | 2Al | 4Si | 10O及び2OH | - | パイロフィライト(蝋石) |
| 2:1 | 3Mg | 4Si | 10O及び2OH | - | タルク(滑石) |
| 2:1 | 2Al | 3Si, Al | 10O及び2OH |
K | ムスコバイト(白雲母) |
| 2:1 | 3Mg | 3Si, Al | 10O及び2OH | K | フロゴバイト(金雲母) |
| 2:1:1 | 3Mg | 3Si, Al | 10O及び2OH | 2Mg, Al, 6OH | クロライト(緑泥石) |
| 2:1 | 5/3Al, 1/3Mg | 4Si | 10O及び2OH | 1/3Na, nH2O | モンモリロナイト |
| 2:1 | 2Al | 11/3Si, 1/3Al | 10O及び2OH | 1/3Na, nH2O | バイデライト |
| 2:1 | 2Al | 10/3Si, 2/3Al | 10O及び2OH | 1/3Mg, 4H2O | 2-八面体型バーミキュライト |
| 2:1 | 3Mg | 10/3Si, 2/3Al | 10O及び2OH | 1/3Mg, 4H2O | 3-八面体型バーミキュライト |
(日本粘土学会編「粘土の世界」より引用)
K:カリウム、Mg:マグネシウム
最も粘土の基本的な構造を有しているのはカオリナイト(カオリン)であり、その他のものはこの基本構造のところどころ陽イオンが置換されたり層間に水や他の陽イオンが入り込んだものです。一般に粘土鉱物の基本構造となるケイ酸塩は非常に複雑な構造を取ることが知られています。その原因はケイ酸塩の次のような性質によるところが大きいようです。
1)ケイ素原子は基本的には4個の酸素原子により囲まれて四面体を形成する(言いかえるとそうでない場合も多々あるということです)。
2)SiO44-イオンは孤立した単位としても存在するが、四面体の隅を共有して重合することもある。
3)Al3+イオンなどでSi4+イオンを置換することができる。
4)SiとOの結合は共有結合とイオン結合の中間にある。つまり、結合角が様々に変化する可能性があります。
下線を引いた箇所から分かるとおりケイ酸塩という物質は非常にフレキシブル、極端に言うといいかげんな性質をもっています。これだけ複雑な構造を取るために産地により様々な粘土を産出するということが理解できるでしょう。(TOP↑)
1-2-1. 成形性のよい粘土の特徴
成形性の良い粘土は一般に次の条件を備えています。
1)「ぬれ」が良いこと。すなわち粒子表面と水との相互作用(主に静電的相互作用=電気の+と-の引き合う力、によります)が大きく、粒子表面に形成される水の皮膜が大きいこと。
2)極めて微細な粒子であること(大体500nm以下)。
3)粒子の形態が扁平であること。
多くの粘土鉱物は多少なりともこの性質を備えています。最もこの性質が大きいのがモンモリロナイトですが、乾燥したときの収縮が大きく、モンモリロナイト単独では成形できませんが、他の粘土に少量添加することにより良好な成形性を発現します。ハロイサイトやセリサイトは粘りが弱く、石英(二酸化ケイ素)や酸化アルミニウムは細かくしても1)や3)やに乏しいため、工業的には結合剤を加えて成形したりします。粘土鉱物は水簸(すいひ)や粉砕を繰り返しても単独では成形に適した物性を有することが少ないため、石英や長石などの非可塑性原料を混合したり添加剤を加えてより望ましい物性を得ていることが多いようです。ほとんどの陶芸家の方は必ず2種類以上の粘土を混合して、自分の作風に適した物性を持つ粘土を作り出しています。ちなみに単独でもっとも成形に適した物性を持つのは堆積性のカオリナイトといわれており、薄板状で陽イオン交換能力が大きいため、電荷が中性からずれやすく、静電的な効果を表面に誘発しやすい性質を持っています。この際置換陽イオンとなるカルシウムやマグネシウムは表面のぬれやすさを増強することが分かっています。
1‐2‐2. インターカレーションによる成形性の改善
粘土の成形性に影響を与えるもう一つの要因としてはインターカレーションがあります。まず、1‐1.で述べたフィロシリケートの構造を思い出してください。粘土のようなアルミノ珪酸塩(珪酸とアルミナの複合体の塩)はシリカとアルミナの複合体からなるシートが何層にも重なったような層構造を持っています。それぞれの層の間は水素結合や分子間力でゆるく結合していますが、粘土はその層間に比較的小さい分子を取り込む性質をもっています(インターカレーション)。取り込まれる物質としては以下のようなものがあります。
・ポリペプタイド
・アミノ酸
・芳香族アミン誘導体
・アルキルアンモニウムイオン
これらの物質に共通する構造としては①疎水性部分が多い②水素結合を助長する原子(窒素や酸素など)が含まれていることが多いようです。これらの分子が層間に入り込むとvan
der Waals力に由来する分子間力、そして水結合の影響等から層間の相互作用が変化し、粘土の可塑性、粘性に変化を与えます。よく、微生物の働きで粘土の成形性が良くなるといいますが、微生物が分泌する有機物(生物は窒素固定作用を持っているので当然窒素を含む物質が多いわけです)が層間に入り込んで成形性を改善するものと考えられます。その他粘土の一次粒子間の結晶粒界における表面張力なども成形性に影響を与えると言われています。
(TOP↑)
粘土は赤土、黒土など様々な色をしたものがあります。最近では合成色素を混ぜたカラー粘土なるものまで登場しています。カラー粘土はさておき、このような粘土の着色の差は何が原因になっているのでしょうか。粘土に限らず、色の話は二章で述べる釉薬にも関連するのでここで少し詳しく述べます。
1‐3‐1. 「色」と「光」の関係
粘土の着色の話に入る前にまず、一般的な「色」の話をします。一つの例題をあげましょう。晴れの日に遠くから見た「海」は何故青いのでしょうか?正解はこうです。「海自身が青いのではなく、青い光の補色を吸収するから青く見える」と。私は小さい頃、この話を子供向けの科学関係の読み物で読んだのですが、今ひとつピンときませんでした。光を吸収する?何やそれ、光に色なんてついてへんやん?といった感じでした。それなりに理解したのは大学に入って分子分光学を習ってからです。私達の直感として光=色の無い明かりといったイメージがあります。光、正確に言うと目に見える可視光線の正体は「様々な波長を持つ電磁波の集まり」です。可視光線は波長の違いにより青や赤、橙や紫といった色を持っています。単一の波長を持つ光は単一の色を持っています。これらが寄せ集まると何故か、白色の光線となってしまうのです。遠くから見た海はいくつかの波長をもつ電磁波のうち、青い光の補色に相当する電磁波だけを特異的に吸収し、あとの色は反射(または透過)してしまう性質をもっています。それによって「青く見える」ことになります。可視光線は波長が大体400~1000nmの電磁波ですが、波長がこれより長くても短くても人間の目では感じ取ることができなくなります。電磁波は可視光線よりも波長が長くなるにつれて赤外線、電波、短くなるにつれて紫外線、X線、γ(ガンマ)線と名前を変えます。レントゲン撮影に使われるX線は実は目に見える光の仲間なのです。
1‐3‐2. 粘土の着色の犯人「鉄」
鉄は原子番号26、元素記号Feの金属元素です。どんな化学音痴でも鉄を知らない人はまずいないと思います。地球上でも地殻の6.2%を占め、その強度、硬度、並びに加工の容易さから古代から人間に利用されてきたポピュラーな物質です。一般的に鉄というとピカピカ光る鉄鋼を思い浮かべると思いますが、これは精製されて鉄原子だけが残った(正確に言うと微量の炭素がまじっているのですが)純度の高い「鉄」です。自然界では鉄はほとんど他の原子と結びついた化合物として存在します。代表的なものとして酸化鉄(FeO,
Fe3O4, Fe2O3)が挙げられます。鉄が錆びると赤くなりますが、これは鉄が酸化されたものです。酸化鉄は主に3種類ありますが、酸化第一鉄FeO及び四三酸化鉄Fe3O4は黒色、酸化第二鉄(弁柄)Fe2O3は赤色をしています。鉄は酸化鉄の形で粘土に含まれることが多く、その含量によって粘土の色調(焼きあがりの色も含めて)に影響に与えます。赤土といわれるものは酸化第二鉄を多く含んでおり、赤く着色したように見えます。また、酸化第二鉄は含量が少なくとも1‐1.で述べた水酸化アルミニウム六面体の中に固溶することもあり、三章で述べる御本手の生成に一役買うようになります。
1‐3‐3. 電子状態からみた鉄の着色の原因
化合物としての鉄の色は主に褐色や黒っぽい色が多いのですが、なぜこのような色がつくのでしょうか?それを説明する前にまず、鉄原子の構造を調べて見ましょう。鉄原子は原子核と、原子番号と同じ数の電子26個を持っています。26個の電子は原子核の周りをてんでばらばらに回っているわけではなく、原子核を中心とした原子軌道(atomic
orbital)とよばれる領域の中に有る一定の確率で存在しています。鉄が有している原子軌道を表2に示します。
表2.鉄原子の原子軌道と収容電子数
| 主量子数 | 軌道 | 収容電子数 | 最大収容電子数 |
| 1 | s | 2 | 2 |
| 2 | s | 2 | 2 |
| 2 | p | 6 | 6 |
| 3 | s | 2 | 2 |
| 3 | p | 6 | 6 |
| 3 | d | 6 | 10 |
| 4 | s | 2 | 2 |
主量子数は各軌道についている固有の番号のようなものです。主量子数が1のものに関しては1s軌道、2のものに関しては2s軌道及び2p軌道と言う風に番号が多くなるにつれて所属する軌道の数が増えていきます。それぞれの軌道には無限に電子が入り込めるわけではなく、定員があります。表2に示すように1s軌道であれば2個、2p軌道であれば6個と言う具合です。定員が満杯になった軌道は電子が入ることも、中に入った電子が出ることもできなくなります(ホントは軌道間の電子交換は頻繁に起こるのですが、巨視的に見たときに状態として変化しないので、出ることができないと考えた方が分かりやすいです)。表2だと3d軌道以外は全て満員となっています。ところが、3d軌道だけは、まだ4個の電子が入ることが可能です。また、既に入っている電子も自由に軌道の外、あるいは原子の外に出ることができます。鉄が電気の良導体であることはこの3d軌道の電子が自由に動くことができる性質に由来しています。
話が少しそれましたが、実はこの3d軌道の電子(以後d電子と呼ぶことにします)は鉄が示す様々な色の原因にもなっているのです。図4にd軌道の形を示します。
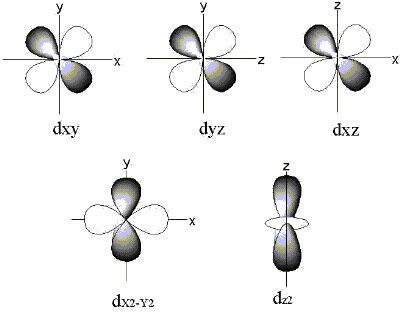
図4.鉄のd軌道の形
鉄のd軌道は図4に示すようにエネルギーの大きさが同じdxy、dyz、dxz、dx2‐y2、dz2の5つの軌道から構成されています。各軌道の座標原点に鉄原子の原子核が存在すると考えてください。それぞれの軌道に最大2個まで、計10個まで電子が入ることが出来ます。軌道というと人工衛星が地球を回っているような円軌道を想像される方も多いと思いますが、電子軌道は図4のように円とは似ても似つかぬプロペラのような形をしています。電子はそれぞれのプロペラのほぼ内側をランダムに動いていると考えてください。各軌道は白と灰色の2色で色分けされていますが、それぞれの色をした軌道に電子が1個ずつ入ります。一つの軌道に収容される2個の電子は実は電子スピン量子数という値で区別されますが、ここでは特にそれを知らなくてもよいので、詳細な説明は省きます。1つの軌道に電子が2個ずつ入るという事実だけ覚えてください。
鉄のd電子数は6個ですから、例えばdxy、dyz、dxzに2個ずつ電子が入って残りの軌道が全て電子なしといった組み合わせも考えられるのですが、電子はできるだけ別々の軌道に入ろうとする性質(Hundの規則と言います)を持っていますから5つの軌道全てにまず1個ずつ電子が収容され、残りの1つはどこかの軌道に2つ目の電子としておさまります。d軌道の中のどこに入るかは経時的にランダムに起こり、議論することはあまり意味がありません。
さて、鉄原子単独、あるいは純粋な鉄の結晶であれば5つの軌道は全て等しいエネルギーを持っているのですが、鉄が酸素やその他の元素と化合して(化合のための化学結合には4S電子2個、あるいは4s電子2個+d電子1個が使われます)鉄原子のとなりに異種の原子が来るとこの5つの軌道はその影響を受けて等しいエネルギーを保つことができなくなります。これを専門用語で「エネルギー準位の分裂」と言いますが、各々の軌道間にエネルギーの差が生じるわけです。分裂の仕方は化合原子の位置に依存しますが、大体下の図5のような感じになります。
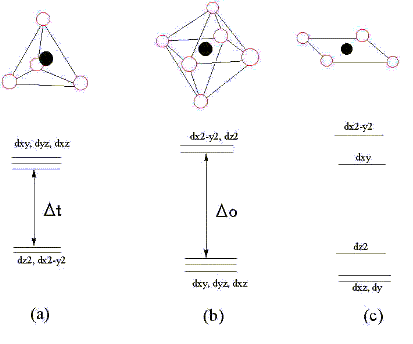
図5. d軌道の分裂様式、黒丸が鉄原子。赤丸が鉄に配位している原子
(a)は鉄原子を中心として四面体型に異種原子が隣り合う(配位といいます)場合です。そうすると軌道エネルギーはdxy, dyz, dxzとdx2, dx2-y2の2つに分裂し、Δtというエネルギー差を生じます。(b)は六面体型に異種原子が配位しているのですが、この場合はdx2-y2, dz2とdxy, dyz, dxzの2つに分裂し、Δo分のエネルギー差が生じます。(c)の平面四配位の場合はもっと複雑で全部で4つのエネルギー準位に分かれてしまいます。
今ここで、四面体型配位の(a)のケースで、この分裂した軌道に鉄のd電子6個を収容することを考えてみましょう。例外はありますが、電子は「Hundの規則」に従い、エネルギーの低い順から各軌道に順番に収容されていきます。まず、5個の軌道に1個ずつ入り残りの一つがエネルギーの低いdz2あるいはdx2‐y2のどちらかの軌道に収まります。結合にd電子1個が使われる場合は5個の軌道に1個ずつ入ってそれで終わりです。各々の電子軌道が満杯になっていなければ電子は各軌道の間を自由に移ることができますから、エネルギー準位が分裂した後も、隙あらば他の軌道に移ろうとします。ところが、dxy、dyz、dxzの軌道に移るためにはΔtというエネルギーを得なければ移ることができません。そこでΔt分のエネルギーを調達してくるのですが、どこから調達すると思いますか?実は電磁波のエネルギーを使うのです。Δtの値は電磁波でいうとちょうど1‐4‐1で述べた可視光の領域に相当します。つまり、電子がエネルギーの低い軌道から高い軌道に移るために(これを遷移といいます)可視光線を吸収し、その可視光の波長の補色に相当する色を発色するのです。同様のことが他の配位様式でも起こります。軌道の分裂様式は図5の3種類以外にもあり、その様式ごとに異なるエネルギー差を生じます。
酸化第二鉄(弁柄)は赤の補色の波長領域の光を吸収し、酸化第1鉄は黒の補色の波長領域の光(正確にいうと複数の波長の光を吸収した結果、黒くみえるのですが)を吸収します。
以上鉄の着色について述べましたが、他の金属元素(コバルト、銅など)についても同様のことが言えます。d軌道の空きが多い金属元素を特に遷移元素と呼ぶこともあります。(TOP↑)
1‐4. 粘土の分析法
最後に粘土の機器分析法について簡単に触れておきます。粘土の分類は主にその結晶構造の違いによることが多く、その違いを反映させることのできる分析法が用いられます。主なものに赤外吸収スペクトル分析(IR)とX線回折分析(XRD)があります。その他、焼成の際の物理化学的変化を検出する熱分析という方法もあります。
赤外吸収スペクトルは原子間の化学結合の伸び縮みや結合角の変化のエネルギーを検出する分析法で、主に構造中にどのような基(例えば水酸基OHなど)が存在するかということを調べることができます。また、これらのエネルギーは結晶構造の違いにより微妙にその値が変わりますので、結晶構造の分かっている標準試料とそのパターンを比較することにより、粘土鉱物の同定を行うこともできます。
X線回折分析は電磁波であるX線を試料に照射したとき、その結晶構造の違いによって特定の反射角で強く反射する性質(回折と呼びます)を利用したものです。X線回折法は結晶学といわれる極めて難解な物理理論を理解していないと詳細な解析が難しいのですが、赤外吸収スペクトルと同様標準試料と回折パターンを比較することで粘土を特定することが可能です。
熱分析は粘土を徐々に加熱していく際の変化等を検出する方法です。特に汎用されているのが示差走査熱量測定(DSC)及び熱重量測定(TG)と呼ばれるもので、前者は相転移や化学反応の際に系に出入りする熱量を直接測定し、後者は重量変化を測定できます。
赤外吸収スペクトル及びX線回折は物質の微視的な化学構造に由来するいわば「ミクロな」状態を測定する方法であり、熱分析は物質を原子集合体として見たときの巨視的な挙動を測定する「マクロな」分析法といえます。これらの分析を組み合わせることにより、粘土の総合的な解析が出来るというわけです。
(TOP↑)