
粘土の精製から始まる一連の陶磁器の製造工程は焼成をもって完結します。焼成は素地を焼き締めて硬くし、かけた釉薬を熔かして素地に固着させる重要な工程で、目に見える以上に多彩な物理化学的反応がその役割を担っています。また、複雑な化学変化は時として予期せぬ結果を生み、「窯変」となります。この章では焼成のメカニズムを見てみることにします。
3‐1‐1. 素焼きと本焼き
最初に素焼きと本焼きの話をしましょう。陶磁器の焼成は素焼き(第一焼成)及び本焼き(第二焼成)に分けられます。本焼きは場合によって第三焼成として複数回行うこともあります。
素焼きは成形した素地を800〜950℃まで焼成し、素地を完全に乾燥させるとともに素地自身を多孔質に変化させます。こうすると施釉したときに釉薬に含まれる水分を表面の細かい穴から吸収しやすくなり、釉薬ののりが良くなります。素焼きの技法は明治以降に欧米から伝わったもので昔の日本の焼き物は備前など素地を焼き締めるものを除いて全て生がけ(素焼きしていない素地にそのまま釉薬をかけること)でした。
本焼きは素焼きした素地に釉薬をかけたもの(あるいは焼き締めを目的として素焼きをしていない素地)を1300℃近辺まで焼成します。本焼きによって釉薬が熔融して素地と固着し、素地自身も固く焼結します。
陶器の焼成は本焼きの場合室温から1200〜1300℃まで温度を上げて行われます。その際、主として以下のような化学変化が起こります。
3‐1‐2. 水の脱離(〜500℃)
いわゆる「炙り(あぶり)」の工程です。成形した作品は素焼きをする前に十分乾燥させて水分を除きますが、見た目に乾燥していても、実は「結合水」という水が残っています。結合水は素地表面とある種の相互作用(水素結合や静電的相互作用が多いようです)を持つ吸着水及び沸石水、さらに粘土の結晶構造の一部となっている結晶水に分けられます。これらの水は図3‐1に示すように粘土の化学構造の中にできる空隙に分子レベルで入り込んでいる場合が多いので、室温で乾燥したくらいでは抜けません(結合水に対して室温乾燥で除去できる水を「付着水」とか「自由水」と呼ぶことがあります)。

図3‐1.粘土の化学構造の中に取り込まれる沸石水の模式図。緑の線は水素結合
付着水は水の沸点である100℃までに大体除去できますが、吸着水や沸石水は200℃程度まで加熱する必要があり、さらに結晶水は500〜600℃くらいまで温度を上げないと除去することはできません。
3‐1‐3.石英の変化(573℃)
さらに温度を上げていくと573℃で素地に含まれている石英の構造変化が起こります。この構造変化は専門的にいうと「熱力学的相転移」と呼ばれるものです。難しそうな呼び方ですが、氷が溶けて水になったりダイヤモンドを加熱すると(そんな人滅多にいないでしょうけど)グラファイト(=炭)に変わるのと同じ現象です。
具体的にどんな現象が起こるかというと石英中に含まれる酸素原子とケイ素原子の並び方が573℃を境に変わってしまうのです。この際、原子間の結合角度が変わるため石英全体の体積は膨張します。速く温度を上げすぎると体積膨張も急に起こるため、素地が割れることがあります。このためこの温度領域はゆっくり昇温することが望ましいのです。
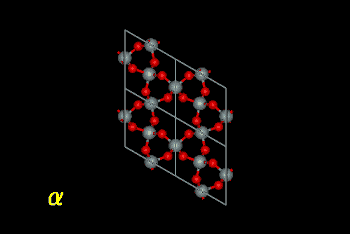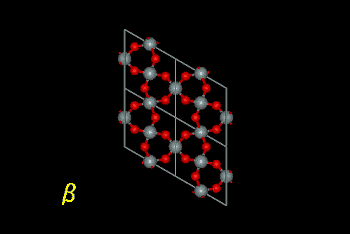
石英のα‐β転移。構造不斉を持つα形から対称性の高い
β形に変化している。また、転移による結晶格子の膨張が見られる。
(赤が酸素、銀色がケイ素原子を表す)
| ※二酸化ケイ素の多形 石英は二酸化ケイ素(珪酸:SiO2)の一種です。一章でも少しふれましたが、二酸化ケイ素のSiとOの結合は共有結合とイオン結合の中間にあり結合角が様々に変化します。このため二酸化ケイ素は様々な原子配列をとり、多くの多形(polymorphism:化学組成が同じで原子の並び方が異なるもの)を有しています。代表的なものとしてα−石英、β−石英、α−クリストバライト、β−クリストバライト、トリディマイト(リンケイ石)、無定形珪酸(石英ガラス)が挙げられます。天然の二酸化ケイ素は殆どがα−石英(珪石)の形で産出し、陶磁器素地の573℃における体積膨張はα−石英からβ−石英への転移によるものです。 純物質としての二酸化ケイ素の熱力学的安定性及び結晶構造は下記のようなものです。α−クリストバライトは室温付近では石英に対して熱力学的に準安定であるため、陶磁器素地中のβ−クリストバライトからα−クリストバライトへの転移は焼成後の降温過程でのみ見られるようです。二酸化ケイ素の固相転移(固体状態における熱力学的相転移)のうち、可逆転移なのは石英及びクリストバライトのα→β転移のみで(従って温度を下げていくと陶磁器の素地は573℃及び268℃で急激に収縮します)、あとの転移は不可逆転移といわれています。
二酸化ケイ素の各種多形の結晶構造(黒丸が酸素、白丸がケイ素を示す)
相の熱力学的安定性の指標となるGibbsの自由エネルギーは温度及び圧力の関数として表されます。したがって、相転移は温度だけでなく、圧力の変化によっても起こります。コーサイトやスティショフ石はβ−石英の圧力相転移により生成します。 |
3-1-4.素地の焼結及び釉薬の熔融
石英の転移点を超えると素地は次第に焼結が進んでいきます。素地は焼成前の化学組成Al2O3・2SiO2・2H2O(ここではカオリナイトの組成式で代表させました)から結晶水が抜けてAl2O3・2SiO2となります。結晶水は結晶格子を形成するいわば「つなぎ」です。したがってこれが脱離すると、家の柱を抜かれるようなものなのでそれまで行儀良く整列していた原子構造が崩れて不規則な並びになります(非晶質化)。この状態をメタカオリン(焼成カオリン)と呼んでいます。メタカオリンは他のメタカオリン粒子や石英、長石粒子と焼き付けを起こして凝集するため、表面及び内部に多くの空孔を含みます。この段階(〜約800℃)で焼成をやめた状態が「素焼き」であり、素地の吸水性にすぐれているため施釉に適しています。
1000℃前後で素地中のメタカオリンはケイ酸分を一部遊離させ、再び結晶化してムライト(mullite:3Al2O3・2SiO2)を生成します。ムライトは素地の骨格となります。
3(Al2O3・2SiO2)→3Al2O3・2SiO2+4SiO2
遊離したケイ酸分は純物質の二酸化ケイ素の挙動よりは低い温度ですが、β−クリストバライトに転移するといわれています。実際の陶磁器素地にはカオリンの他に長石やアルカリ分等に由来する媒熔成分が混入しています。これらの媒熔成分は結晶であるクリストバライトや石英をより低い温度で熔かして融液(媒熔成分が混入した熔融石英)となります。その他、長石等の成分も熔融し、これがムライトの微結晶を取り込んで急速に焼き締まります。昇温停止後、冷却過程においてムライトやクリストバライトの析出が進みます。結晶化せずに残った溶融物の一部は結晶粒子間を埋めた形のままガラス転移によって固化し、これにより素地全体が固化して焼成反応が完了します。
一方、素地を覆う釉薬においても同様の反応が起こります。釉薬は基本的に素地と同じ、アルカリ及びアルカリ土類の酸化物、アルミナ、二酸化ケイ素からなっていますが、媒熔剤と二酸化ケイ素の比率が素地より大きくなっています。(一章のカオリナイトの化学組成と二章のゼーゲル式を比較してみてください)。したがって、素地よりもずっと低い温度で熔融します。また、素地の骨格となるムライトの生成量が減って代わりに媒熔成分が混入した熔融石英の量が増えます。その結果、熔融石英はガラス状の薄膜として素地表面を覆うことになります。
図3‐2にAl2O3−SiO2系の二成分系状態図を示します。
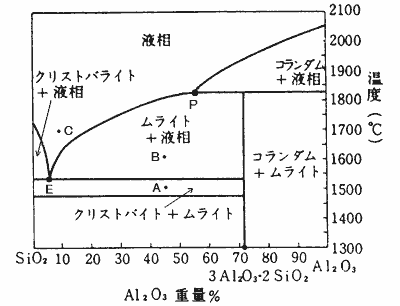
図3‐2. Al2O3−SiO2系の二成分系状態図
粘土の組成は大体モル比でAl2O3:SiO2=1:2ですからAl2O3の重量比での百分率が46%程度になります。この点から垂直に伸ばした、図中の点Aが存在する領域(1450℃〜1550℃程度、クリストバライト+ムライトの二相領域)がメタカオリンから珪酸が分離した状態を示しています。さらに温度を上げたB点ではクリストバライトが熔融しムライト+液相の状態になっています。さらに温度を上げるとムライトも熔融して単一の液相になります。釉薬の組成(透明釉)を示す点Cは共融点Eに近い組成になっているため、粘土よりはずっと低い温度で熔融することがこの図から分かります。上の状態図は純粋なシリカとアルミナのものですが、実際の粘土や釉薬には媒熔成分が入っているためこれらの挙動がずっと低い温度(1300℃程度)で起こります(Top↑)。
3-2-1.「温度」と「熱」
「焼き物の焼成で大事なのは温度ではなく熱(量)である」窯焚きをしたことのある人であれば誰もが聞いたことのある言葉だと思います。では温度と熱とは一体なんなのでしょうか?具体的にどこが違うのでしょうか?
温度は熱力学的には「状態量」と呼ばれています。状態量は系が平衡状態(それ以上変化しない状態)にあるときに一義的に決まる量と定義され、温度の他に体積や圧力なども状態量です。例えば25℃の部屋に1Lの氷を放置したとしましょう。氷は室温が高いためどんどん溶けていきます。この状態ではまだ平衡状態ではありません。氷が溶けて水となり、その温度が室温と同じ25℃になって初めて平衡状態、すなわちそれ以上変化しない状態になります。このとき周りの25℃の空気は氷に「熱」を与え、その結果「温度」が上昇します。熱は状態量ではありませんが、温度を上昇させるためのいわばドライビングフォースと考えて良いでしょう。
熱と温度の間には一般に次の関係が成立しています。
熱(量)=定数×(熱を加えた後の温度−熱を加える前の温度)
ここで定数は系の温度を1℃上昇させるために必要な熱で熱容量(heat capacity)、あるいは比熱と呼ばれています。熱容量は物質(あるいは系)固有の値で、一般に純物質であればその大きさは固体>液体>気体の順になっています。熱容量が大きくなると当然温度を上げるための熱量も沢山必要になります。窯に入れる作品の数が多くなると焼成に時間がかかるのはこのためです。
3‐2‐2.焼き物の焼成と熱量
焼き物の焼成は科学的に言えば作品に熱量を与えて3‐1で述べた化学反応を起こさせる一種の「無機合成」です。作品に与える熱量は薪や灯油、あるいはガスなどを燃焼させて得られますが、本来熱量は上の式で表すように温度変化と熱容量だけで決まるものであり、時間や窯の大きさによりません。しかし、窯が大きくなるほど、作品が多くなるほど焼成に時間がかかります。例えば温度を上げても焼成時間が短かったりすると作品が焼きあがらなかったりします。これは焼成の際に熱が一部窯の外に輻射熱として逃げてしまっているからです。夏に窯焚きをすると室温が一気に上がる経験をした人も多いと思いますがこれは逃げた熱によるものです。逆に言うと熱量さえ、決まった値を与えると時間に関係無く作品は焼きあがることになります。
| ※焼成と熱力学の第一法則 熱力学には基本的な法則が三つありますが、最も一般的なものはエネルギー保存則を示す第一法則です。言葉で表すと 「閉じた系が第一の平衡状態から第二の平衡状態に移る過程で、外界から熱量( q )を吸収し、また、外界から仕事(w) をされたとすると、その和(q +w)の値は途中の経路によらず、初めと終わりだけの状態で決まる」 というものです。 「焼き物の焼成は加える熱量及び酸化か還元かを規定しておけば焼成時間によらず焼きあがりは同じになる」 といったところでしょうか?実際の焼き物の焼成は熱力学で考慮しない化学反応や相転移による熱の出入り、副反応による窯変などがあり、厳密に第一法則が成り立つことはありません。しかし、焼きあがりの定義を「釉調」とか、焼き物の力学的性質を表す「ヤング率」とか許容範囲を広くすると成り立つようになってきます。 |
3-3-1. 酸化還元のメカニズム
焼成の雰囲気には酸化、中性及び還元焼成があります。「燃焼」という現象は基本的には炭素と酸素が化合して二酸化炭素となることです。焼き物の焼成においてもそれは変わりません。常に炭素(燃料)と酸素(空気)を供給して燃焼を持続させるという作業が必要になります。炭素と酸素は1モルずつ反応して二酸化炭素となります。この反応が定量的に進行する場合は中性炎焼成となります。
C+O2→CO2
しかし、供給する炭素と酸素の割合が1モル対1モルから外れるとどうなるでしょう?まず酸素が過剰になる場合を考えてみましょう。本来燃焼反応が完全に進めば生成系に酸素は残らないはずですが、供給酸素が過剰になると反応しきらなかった酸素が窯の中に残ることになります。酸素は非常に反応性の高い物質で、釉薬や素地に含まれる金属分や無機物と化合します。これが酸化焼成の状態です。
逆に炭素が過剰になると二酸化炭素への化学変換が十分進行しなくなって不完全燃焼の状態となり、反応生成物として一酸化炭素が増加するほか、未反応炭素が煤となります。
2C+O2→2CO
一酸化炭素は酸素よりもさらに反応性の高い物質です。容易に酸素と反応して二酸化炭素となりやすい性質を持っています。これが窯の中に増加すると釉薬や素地中の酸化物から酸素を奪い取ります。これが還元焼成の原理です。
さて、実際に燃料となるのは炭素単体ではなく、灯油やLPGなど、主に炭化水素が用いられます。両者に含まれる成分のうち代表的なものとして鎖式の飽和炭化水素(パラフィン)を考えてみましょう。鎖式のパラフィンは一般式としてCnH2n+2で表されます。パラフィンの燃焼は一般に下に示すようになります。
CnH2n+2+(3n+1/2)O2→nCO2+(n+1)H2O (n=1,2,3…)
上記の反応はさらに二段階に分けることができます。
反応1.炭化水素の熱分解
CnH2n+2→nC+(n+1)H2
反応2.水素及び炭素の反応
nC+(n+1)H2+(3n+1/2)O2→ nCO2+(n+1)H2O
反応2では炭素及び水素の両方が同時に燃焼することになりますが、実際は水素の方がはるかに燃えやすいため、まず水素の燃焼による熱エネルギーが発生し、それによって炭素の燃焼が加速されるようになります。反応2における炭素と水素のモル数の比、n:n+1は、n数が増える(=炭素数が増加する)と炭素に対する水素の割合が少なくなります。これは炭素数が多くなると炭素の燃焼を促進する役割を担う水素の比率が少なくなり、不完全燃焼になりやすいことを意味しています。
余談ですが、不飽和炭化水素は飽和炭化水素よりも炭素に対する水素の割合が少ないためにより還元がかかりやすく、さらに水素の少ない芳香族炭化水素はその上を行きます。ベンゼンなどは燃やすと大量の煤が発生することは有機合成の経験のある方は良くご存知でしょう。縮合型芳香族炭化水素のナフタレンは実際にさやに入れて焼成することもあると聞きます。ナフタレンよりもアントラセン、アントラセンよりもピレンといった風にベンゼン環の数が増えていけば出る煤の量も増えるのでしょうが・・・。あんまり試したくはないですけどね・・・(笑)。
3-3-2. 窯の種類による焼成雰囲気の違い
①電気窯
先ほど燃焼は炭素と酸素の化合だと説明しましたが、唯一の例外がこの電気窯です。電気窯は電熱線に電気を通し、その発熱により焼成を行います。つまり燃焼を利用するものではありません。したがって炭素の供給を行わないため、基本的には酸化焼成のみとなりますが、炭化水素ガスを導入したりさや鉢に炭を入れて炭化焼成をすることで還元状態を実現することができます。
②ガス窯
ガス窯の燃料は主にLPGや天然ガスです。これらの主成分はメタンやプロパンなど、分子量の小さい炭化水素が中心となります。したがって焼成反応は比較的スムーズに進行し、普通に燃やせば煤はそれほど出ません。燃焼系に適切に炭素と酸素を供給することができるため、酸化還元の制御が容易と考えられます。
③灯油窯
一般的な灯油窯であれば燃料は白灯油(1号灯油)を用います。これらの主成分は炭素数が10以上の炭化水素が中心になります。また、不飽和炭化水素や芳香族炭化水素も含まれるため、灯油は蛍光を発します。ガスと灯油は全く別物と考えられがちですが、炭化水素と言う点では「同族体」のカテゴリーでくくっても良いと思います。ただし灯油に含まれる炭化水素は炭素数が多いため、上記に述べたように不完全燃焼になりやすく、特に低温では還元焼成に偏りがちです。
④薪窯
薪の主成分は糖性高分子のセルロースです。セルロースは炭化水素と比べて燃えにくく、炭素の数もはるかに多い物質ですので還元の度合いがさらに強くなると考えられます。薪窯で酸化焼成を適切に行うのはかなり難しいでしょう。薪をくべるとどうしても還元雰囲気になりやすくなります。薪にはそのほかにリグニン、レジン(樹脂)、少量の精油やケイ酸、アルミナ、ナトリウムやカリウムなどを含んでいます。強熱残分となる珪酸やアルカリは、素地と反応してガラス化し、いわゆる「灰被り」の状態になります。
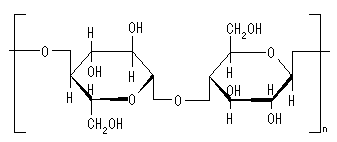
セルロース
(Top↑)
To Be Continued・・・